Terjemahan mRNA
post. by phuru 09 Nov. 2011
Protein yang disintesis dari template mRNA dengan proses yang telah sangat dilestarikan sepanjang evolusi (terakhir pada Bab 3). Semua mRNA dibaca dalam 5 'ke 3' arah, dan polipeptida rantai disintesis dari amino terminal karboksi. Setiap asam amino ditentukan oleh tiga basa (a kodon ) pada mRNA, menurut yang hampir universal, kode genetik . Mekanisme dasar dari sintesis protein juga sama di semua sel: Terjemahan dilakukan pada ribosom , dengan tRNA melayani sebagai adapter antara template mRNA dan asam amino yang dimasukkan ke dalam protein. Sintesis protein sehingga melibatkan interaksi antara tiga jenis molekul RNA (mRNA template, tRNA, dan rRNA), serta berbagai protein yang diperlukan untuk penerjemahan .
Selama penerjemahan , masing-masing dari 20 asam amino harus selaras dengan yang sesuai mereka kodon mRNA pada template. Semua sel mengandung berbagai tRNA yang berfungsi sebagai adapter untuk proses ini. Seperti yang mungkin diharapkan, mengingat fungsi umum mereka dalam sintesis protein, tRNA yang berbeda berbagi struktur secara keseluruhan mirip. Namun, mereka juga memiliki urutan yang unik yang memungkinkan identifikasi yang benar asam amino harus terpasang dan selaras dengan yang sesuai kodon pada mRNA.
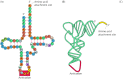
RNA transfer sekitar 70 sampai 80 nukleotida panjang dan memiliki struktur daun semanggi karakteristik yang dihasilkan dari pasangan basa komplementer antara daerah yang berbeda dari molekul ( Gambar 7.1 ). kristalografi sinar-X penelitian lebih lanjut menunjukkan bahwa semua tRNA lipat menjadi bentuk L yang sama kompak, yang mungkin diperlukan untuk tRNA sesuai ke ribosom selama terjemahan proses. Fungsi adaptor dari tRNA melibatkan dua wilayah terpisah dari molekul. Semua tRNA memiliki urutan CCA pada ujung 3 mereka, dan asam amino yang kovalen melekat pada ribosa terminal adenosin. Template mRNA kemudian diakui oleh antikodon loop, terletak di ujung tRNA dilipat, yang mengikat yang sesuai kodon dengan pasangan basa komplementer.
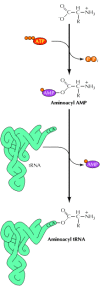
Penggabungan dengan benar dikodekan asam amino ke dalam protein tergantung pada lampiran masing-masing asam amino ke tRNA yang tepat, serta pada spesifisitas kodon - antikodon perpasangan basa. Lampiran asam amino untuk tRNA spesifik diperantarai oleh sekelompok enzim yang disebut tRNA sintetase aminoasil , yang ditemukan oleh Paul Zamecnik dan Mahlon Hoagland pada tahun 1957. Masing-masing enzim mengakui satu asam amino , serta tRNA yang benar (atau tRNA) yang bahwa asam amino harus dilampirkan. Reaksi hasil dalam dua langkah ( Gambar 7.2 ). Pertama, asam amino diaktifkan oleh reaksi dengan ATP untuk membentuk AMP sintetase aminoasil menengah. Diaktifkan asam amino kemudian bergabung ke ujung 3 'tRNA. Para aminoasil tRNA sintetase harus sangat selektif enzim yang mengakui baik individu asam amino dan urutan basa spesifik yang mengidentifikasi akseptor tRNA yang benar. Dalam beberapa kasus, kesetiaan tinggi asam amino hasil pengakuan sebagian dari proofreading fungsi dimana AMP aminoasil salah yang dihidrolisa bukannya bergabung ke tRNA pada langkah kedua reaksi. Pengakuan tRNA benar oleh tRNA sintetase aminoasil juga sangat selektif; sintetase mengakui spesifik nukleotida urutan (dalam banyak kasus termasuk antikodon ) yang secara unik mengidentifikasi setiap spesies tRNA.
Setelah melekat pada tRNA, suatu asam amino sejajar pada template mRNA oleh pasangan basa komplementer antara mRNA kodon dan antikodon tRNA tersebut. Kodon - antikodon perpasangan basa agak kurang ketat dari AU standar dan pasangan basa GC dibahas di sebelumnya bab. Pentingnya hal ini perpasangan basa yang tidak biasa di kodon - antikodon pengakuan berkaitan dengan redundansi dari kode genetik . Dari 64 kemungkinan kodon , tiga adalah menghentikan kodon bahwa sinyal penghentian penerjemahan , sedangkan 61 lainnya menyandikan asam amino (lihat Tabel 3.1 ). Dengan demikian, sebagian besar asam amino ditentukan oleh lebih dari satu kodon . Pada bagian, hasil redundansi ini dari lampiran banyak asam amino ke lebih dari satu jenis tRNA E.. coli, misalnya, mengandung sekitar 40 tRNA yang berbeda yang berfungsi sebagai akseptor yang berbeda untuk 20 asam amino . Selain itu, beberapa tRNA yang dapat mengenali lebih dari satu kodon pada mRNA, sebagai akibat dari perpasangan basa yang tidak standar (disebut goyangan) antara tRNA antikodon dan posisi ketiga dari beberapa pelengkap kodon ( Gambar 7.3 ). Santai basis pasangan pada posisi ini sebagian hasil dari pembentukan pasangan basa GU dan sebagian dari modifikasi guanosin untuk inosin di anticodons dari beberapa tRNA selama pemrosesan (lihat Gambar 6.38 ). Inosin dapat mendasarkan-pasangan dengan baik C, U, atau A di posisi ketiga, sehingga dimasukkan dalam antikodon tRNA memungkinkan tunggal untuk mengenali tiga yang berbeda kodon mRNA dalam template.
RNA transfer sekitar 70 sampai 80 nukleotida panjang dan memiliki struktur daun semanggi karakteristik yang dihasilkan dari pasangan basa komplementer antara daerah yang berbeda dari molekul ( Gambar 7.1 ). kristalografi sinar-X penelitian lebih lanjut menunjukkan bahwa semua tRNA lipat menjadi bentuk L yang sama kompak, yang mungkin diperlukan untuk tRNA sesuai ke ribosom selama terjemahan proses. Fungsi adaptor dari tRNA melibatkan dua wilayah terpisah dari molekul. Semua tRNA memiliki urutan CCA pada ujung 3 mereka, dan asam amino yang kovalen melekat pada ribosa terminal adenosin. Template mRNA kemudian diakui oleh antikodon loop, terletak di ujung tRNA dilipat, yang mengikat yang sesuai kodon dengan pasangan basa komplementer.


Ribosom adalah situs sintesis protein di kedua prokariotik dan sel eukariotik . Pertama ditandai sebagai partikel dideteksi dengan ultrasentrifugasi dari lisat sel, ribosom biasanya ditunjuk sesuai dengan tarif mereka sedimentasi: 70S untuk bakteri ribosom dan 80-an untuk agak lebih besar ribosom dari sel eukariotik . Kedua prokariotik dan eukariotik ribosom terdiri dari dua subunit yang berbeda, masing-masing berisi karakteristik protein dan rRNA. Fakta bahwa sel-sel biasanya mengandung banyak ribosom mencerminkan pentingnya pusat sintesis protein dalam metabolisme sel E.. coli, misalnya, mengandung sekitar 20.000 ribosom , yang menyumbang sekitar 25% dari berat kering sel, dan tumbuh cepat sel mamalia mengandung sekitar 10 juta ribosom .
Struktur umum dari prokariotik dan eukariotik ribosom yang serupa, meskipun mereka berbeda dalam beberapa rincian ( Gambar 7.4 ). . Subunit kecil (ditunjuk 30S) dari E coli ribosom terdiri dari 16S rRNA dan 21 protein , subunit besar (50S) terdiri dari 23S rRNA dan 5S dan 34 protein . Setiap ribosom berisi satu salinan dari rRNA dan satu salinan dari masing-masing ribosom protein , dengan satu pengecualian: Salah satu protein subunit 50S hadir dalam empat salinan. Subunit dari eukariotik ribosom lebih besar dan mengandung lebih protein daripada rekan-rekan mereka telah prokariotik. Subunit kecil (40S) dari eukariotik ribosom terdiri dari rRNA 18S dan sekitar 30 protein , subunit besar (60s) berisi 28S, 5.8S, dan 5S rRNA dan sekitar 45 protein .

Sebuah fitur penting dari ribosom adalah bahwa mereka dapat dibentuk secara in vitro oleh self-assembly dari RNA dan protein konstituen. Seperti pertama kali dijelaskan pada 1968 oleh Masayasu Nomura, ribosom dimurnikan protein dan rRNA dapat dicampur bersama-sama dan, di bawah kondisi yang sesuai, akan reformasi ribosom fungsional. Meskipun perakitan ribosom secara in vivo (khususnya di sel eukariotik ) adalah jauh lebih rumit, kemampuan ribosom untuk merakit diri secara in vitro telah memberikan alat eksperimental yang penting, memungkinkan analisis peran individu protein dan rRNA.
Seperti tRNA, rRNA bentuk karakteristik struktur sekunder dengan pasangan basa komplementer ( Gambar 7.5 ). Dalam kaitannya dengan ribosomal protein rRNA lipat lebih lanjut, menjadi berbeda struktur tiga dimensi. Awalnya, rRNA dianggap memainkan peran struktural, menyediakan perancah atas mana ribosom protein merakit. Namun, dengan penemuan aktivitas katalitik dari molekul RNA lainnya (misalnya, RNase P dan diri splicing intron dibahas dalam Bab 6), peran katalitik kemungkinan rRNA menjadi luas dianggap. Konsisten dengan hipotesis ini, rRNA ditemukan benar-benar diperlukan untuk perakitan in vitro dalam fungsional ribosom . Di sisi lain, penghilangan banyak ribosom protein mengakibatkan penurunan, tapi bukan kerugian lengkap, aktivitas ribosom.
Bukti langsung untuk aktivitas katalitik dari rRNA pertama datang dari eksperimen Noller Harry dan rekan-rekannya pada tahun 1992. Peneliti ini menunjukkan bahwa subunit ribosom besar mampu mengkatalisis pembentukan ikatan peptida (reaksi peptidil transferase) bahkan setelah sekitar 95% dari ribosom protein telah dihapus dengan prosedur ekstraksi protein standar. Sebaliknya, pengobatan dengan RNase sepenuhnya menghapuskan ikatan peptida pembentukan, memberikan dukungan kuat untuk hipotesis bahwa pembentukan ikatan peptida adalah reaksi RNA-dikatalisis. Penelitian lebih lanjut telah dikonfirmasi dan diperpanjang hasil ini dengan menunjukkan bahwa reaksi peptidil transferase dapat dikatalisis oleh fragmen 23S rRNA sintetis dalam ketiadaan total setiap protein ribosom. Dengan demikian, reaksi dasar sintesis protein dikatalisis oleh RNA ribosom. Alih-alih menjadi konstituen katalitik utama ribosom , ribosom protein sekarang berpikir untuk memfasilitasi lipat yang tepat dari rRNA dan untuk meningkatkan fungsi ribosom dengan benar posisi tRNA.
Keterlibatan langsung dari rRNA dalam reaksi peptidil transferase memiliki implikasi evolusioner penting. RNA diperkirakan telah menjadi mereplikasi diri makromolekul pertama (lihat Bab 1). Gagasan ini sangat didukung oleh fakta bahwa ribozim , seperti RNase P dan diri splicing intron , dapat mengkatalisis reaksi yang melibatkan RNA substrat . Peran rRNA dalam pembentukan ikatan peptida memperluas kegiatan katalitik RNA di luar diri-replikasi untuk keterlibatan langsung dalam sintesis protein. Studi tambahan menunjukkan bahwa Tetrahymena rRNA ribozim dapat mengkatalisis lampiran asam amino ke RNA, pinjaman kepercayaan untuk kemungkinan bahwa aslinya tRNA sintetase aminoasil adalah RNA, bukan protein . Kemampuan molekul RNA untuk mengkatalisis reaksi yang diperlukan untuk sintesis protein serta untuk diri-replikasi dapat memberikan link penting untuk memahami evolusi awal sel.
Struktur umum dari prokariotik dan eukariotik ribosom yang serupa, meskipun mereka berbeda dalam beberapa rincian ( Gambar 7.4 ). . Subunit kecil (ditunjuk 30S) dari E coli ribosom terdiri dari 16S rRNA dan 21 protein , subunit besar (50S) terdiri dari 23S rRNA dan 5S dan 34 protein . Setiap ribosom berisi satu salinan dari rRNA dan satu salinan dari masing-masing ribosom protein , dengan satu pengecualian: Salah satu protein subunit 50S hadir dalam empat salinan. Subunit dari eukariotik ribosom lebih besar dan mengandung lebih protein daripada rekan-rekan mereka telah prokariotik. Subunit kecil (40S) dari eukariotik ribosom terdiri dari rRNA 18S dan sekitar 30 protein , subunit besar (60s) berisi 28S, 5.8S, dan 5S rRNA dan sekitar 45 protein .

Seperti tRNA, rRNA bentuk karakteristik struktur sekunder dengan pasangan basa komplementer ( Gambar 7.5 ). Dalam kaitannya dengan ribosomal protein rRNA lipat lebih lanjut, menjadi berbeda struktur tiga dimensi. Awalnya, rRNA dianggap memainkan peran struktural, menyediakan perancah atas mana ribosom protein merakit. Namun, dengan penemuan aktivitas katalitik dari molekul RNA lainnya (misalnya, RNase P dan diri splicing intron dibahas dalam Bab 6), peran katalitik kemungkinan rRNA menjadi luas dianggap. Konsisten dengan hipotesis ini, rRNA ditemukan benar-benar diperlukan untuk perakitan in vitro dalam fungsional ribosom . Di sisi lain, penghilangan banyak ribosom protein mengakibatkan penurunan, tapi bukan kerugian lengkap, aktivitas ribosom.
Bukti langsung untuk aktivitas katalitik dari rRNA pertama datang dari eksperimen Noller Harry dan rekan-rekannya pada tahun 1992. Peneliti ini menunjukkan bahwa subunit ribosom besar mampu mengkatalisis pembentukan ikatan peptida (reaksi peptidil transferase) bahkan setelah sekitar 95% dari ribosom protein telah dihapus dengan prosedur ekstraksi protein standar. Sebaliknya, pengobatan dengan RNase sepenuhnya menghapuskan ikatan peptida pembentukan, memberikan dukungan kuat untuk hipotesis bahwa pembentukan ikatan peptida adalah reaksi RNA-dikatalisis. Penelitian lebih lanjut telah dikonfirmasi dan diperpanjang hasil ini dengan menunjukkan bahwa reaksi peptidil transferase dapat dikatalisis oleh fragmen 23S rRNA sintetis dalam ketiadaan total setiap protein ribosom. Dengan demikian, reaksi dasar sintesis protein dikatalisis oleh RNA ribosom. Alih-alih menjadi konstituen katalitik utama ribosom , ribosom protein sekarang berpikir untuk memfasilitasi lipat yang tepat dari rRNA dan untuk meningkatkan fungsi ribosom dengan benar posisi tRNA.
Keterlibatan langsung dari rRNA dalam reaksi peptidil transferase memiliki implikasi evolusioner penting. RNA diperkirakan telah menjadi mereplikasi diri makromolekul pertama (lihat Bab 1). Gagasan ini sangat didukung oleh fakta bahwa ribozim , seperti RNase P dan diri splicing intron , dapat mengkatalisis reaksi yang melibatkan RNA substrat . Peran rRNA dalam pembentukan ikatan peptida memperluas kegiatan katalitik RNA di luar diri-replikasi untuk keterlibatan langsung dalam sintesis protein. Studi tambahan menunjukkan bahwa Tetrahymena rRNA ribozim dapat mengkatalisis lampiran asam amino ke RNA, pinjaman kepercayaan untuk kemungkinan bahwa aslinya tRNA sintetase aminoasil adalah RNA, bukan protein . Kemampuan molekul RNA untuk mengkatalisis reaksi yang diperlukan untuk sintesis protein serta untuk diri-replikasi dapat memberikan link penting untuk memahami evolusi awal sel.
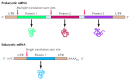
Meskipun mekanisme sintesis protein dalam prokariotik dan sel eukariotik yang sama, ada juga perbedaan, terutama dalam sinyal yang menentukan posisi di mana sintesis polipeptida rantai dimulai pada template mRNA ( Gambar 7.6 ). Terjemahan tidak hanya mulai pada ujung 5 'mRNA, melainkan dimulai di lokasi inisiasi tertentu. 5 'terminal bagian dari mRNA baik prokariotik dan eukariotik karena itu urutan noncoding, disebut sebagai 5' daerah tidak diterjemahkan. MRNA eukariotik biasanya mengkodekan hanya satu polipeptida rantai, tapi mRNA banyak prokariotik menyandikan beberapa polipeptida yang disintesis secara independen dari situs inisiasi yang berbeda. Sebagai contoh, E coli. Lac operon terdiri dari tiga gen yang diterjemahkan dari mRNA yang sama (lihat Gambar 6.8 ). Messenger RNA yang mengkode beberapa polipeptida disebut polisistronik , sedangkan monosistronik menyandikan mRNA tunggal polipeptida rantai. Akhirnya, baik prokariotik dan eukariotik mRNA diterjemahkan berakhir di daerah noncoding 3 '.
Dalam kedua prokariotik dan sel eukariotik , terjemahan selalu memulai dengan asam amino metionin, biasanya dikodekan oleh Agustus Alternatif inisiasi kodon , seperti GUG, digunakan sesekali dalam bakteri, tetapi ketika mereka terjadi pada awal polipeptida rantai, ini kodon langsung penggabungan metionin bukan dari asam amino mereka biasanya mengkodekan (encode biasanya GUG valin). Dalam sebagian besar bakteri, sintesis protein dimulai dengan residu metionin diubah (N-formilmetionin), sedangkan methionine dimodifikasi memulai sintesis protein pada eukariota (kecuali dalam mitokondria dan kloroplas , yang ribosom mirip dengan bakteri).
Sinyal yang mengidentifikasi inisiasi kodon berbeda dalam prokariotik dan sel eukariotik , konsisten dengan fungsi yang berbeda dari polisistronik dan monosistronik mRNA ( Gambar 7.7 ). Inisiasi kodon mRNA bakteri dalam didahului oleh suatu urutan tertentu (disebut urutan Shine-Delgarno , setelah penemunya) yang sejalan mRNA pada ribosom untuk penerjemahan oleh basis-pasangan dengan urutan komplementer dekat terminal 3 'rRNA 16S. Interaksi dasar-pasangan memungkinkan bakteri ribosom untuk memulai terjemahan tidak hanya pada ujung 5 'dari mRNA, tetapi juga di lokasi inisiasi internal polisistronik pesan. Sebaliknya, ribosom yang paling mengenali mRNA eukariotik dengan mengikat topi 7-methylguanosine pada ujung 5 mereka "(lihat Gambar 6.39 ). Para ribosom kemudian memindai hilir tutup 5 'sampai mereka menemukan sebuah inisiasi Agustus kodon . Urutan yang mengelilingi AUGs mempengaruhi efisiensi inisiasi, sehingga dalam banyak kasus Agustus pertama dalam mRNA dilewati dan terjemahan inisiat pada Agustus jauh hilir. Namun, mRNA eukariotik tidak memiliki urutan setara dengan urutan Shine-Delgarno mRNA prokariotik. Terjemahan mRNA eukariotik adalah bukan dimulai di sebuah situs ditentukan oleh memindai dari terminal 5 ', sesuai dengan fungsi mereka sebagai monosistronik pesan yang menyandikan hanya tunggal polipeptida .
Dalam kedua prokariotik dan sel eukariotik , terjemahan selalu memulai dengan asam amino metionin, biasanya dikodekan oleh Agustus Alternatif inisiasi kodon , seperti GUG, digunakan sesekali dalam bakteri, tetapi ketika mereka terjadi pada awal polipeptida rantai, ini kodon langsung penggabungan metionin bukan dari asam amino mereka biasanya mengkodekan (encode biasanya GUG valin). Dalam sebagian besar bakteri, sintesis protein dimulai dengan residu metionin diubah (N-formilmetionin), sedangkan methionine dimodifikasi memulai sintesis protein pada eukariota (kecuali dalam mitokondria dan kloroplas , yang ribosom mirip dengan bakteri).
Sinyal yang mengidentifikasi inisiasi kodon berbeda dalam prokariotik dan sel eukariotik , konsisten dengan fungsi yang berbeda dari polisistronik dan monosistronik mRNA ( Gambar 7.7 ). Inisiasi kodon mRNA bakteri dalam didahului oleh suatu urutan tertentu (disebut urutan Shine-Delgarno , setelah penemunya) yang sejalan mRNA pada ribosom untuk penerjemahan oleh basis-pasangan dengan urutan komplementer dekat terminal 3 'rRNA 16S. Interaksi dasar-pasangan memungkinkan bakteri ribosom untuk memulai terjemahan tidak hanya pada ujung 5 'dari mRNA, tetapi juga di lokasi inisiasi internal polisistronik pesan. Sebaliknya, ribosom yang paling mengenali mRNA eukariotik dengan mengikat topi 7-methylguanosine pada ujung 5 mereka "(lihat Gambar 6.39 ). Para ribosom kemudian memindai hilir tutup 5 'sampai mereka menemukan sebuah inisiasi Agustus kodon . Urutan yang mengelilingi AUGs mempengaruhi efisiensi inisiasi, sehingga dalam banyak kasus Agustus pertama dalam mRNA dilewati dan terjemahan inisiat pada Agustus jauh hilir. Namun, mRNA eukariotik tidak memiliki urutan setara dengan urutan Shine-Delgarno mRNA prokariotik. Terjemahan mRNA eukariotik adalah bukan dimulai di sebuah situs ditentukan oleh memindai dari terminal 5 ', sesuai dengan fungsi mereka sebagai monosistronik pesan yang menyandikan hanya tunggal polipeptida .
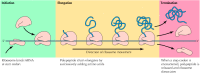
Terjemahan umumnya dibagi menjadi tiga tahap: inisiasi, elongasi, dan terminasi ( Gambar 7.8 ). Dalam kedua prokariota dan eukariota langkah pertama dari tahap inisiasi adalah pengikatan tRNA inisiator methionyl spesifik dan mRNA untuk subunit ribosom kecil. Subunit ribosom besar maka bergabung kompleks, membentuk ribosom fungsional yang pemanjangan polipeptida rantai hasil. Sejumlah nonribosomal spesifik protein juga diperlukan untuk berbagai tahap penerjemahan proses ( Tabel 7.1 ).
Yang pertama terjemahan langkah dalam bakteri adalah mengikat dari tiga faktor inisiasi (IF-1, IF-2, dan IF-3) dengan subunit ribosom 30S ( Gambar 7.9 ). MRNA dan inisiator N-formylmethionyl tRNA kemudian bergabung kompleks, dengan IF-2 (yang terikat GTP) khusus mengakui tRNA inisiator. JIKA-3 kemudian dilepaskan, memungkinkan 50S subunit ribosom untuk mengasosiasikan dengan kompleks. Asosiasi ini memicu hidrolisis GTP terikat IF-2, yang mengarah ke rilis IF-1 dan IF-2 (terikat untuk PDB). Hasilnya adalah pembentukan kompleks inisiasi 70S (dengan mRNA dan tRNA inisiator terikat ribosom) yang siap untuk memulai ikatan peptida pembentukan selama tahap pemanjangan penerjemahan .
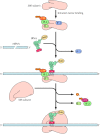
Inisiasi pada eukariota lebih rumit dan membutuhkan setidaknya sepuluh protein (masing-masing terdiri dari beberapa polipeptida rantai), yang ditunjuk EIFS (e ukaryotic i nitiation f aktor, lihat Tabel 7.1 ). Faktor-faktor EIF-1, EIF-1A, dan EIF-3 mengikat ribosom subunit 40S, dan EIF-2 (di sebuah kompleks dengan GTP) asosiasi dengan tRNA inisiator methionyl ( Gambar 7.10 ). MRNA diakui dan dibawa ke ribosom oleh kelompok EIF-4 faktor. Tutup 5 'mRNA yang diakui oleh EIF-4E. Faktor lain, EIF-4G, mengikat baik EIF-4E dan protein (poli-Sebuah protein yang mengikat atau PABP) terkait dengan ekor poli-A pada ujung 3 'mRNA. Faktor inisiasi eukariotik sehingga mengenali baik 5 'dan 3' ujung mRNA, akuntansi untuk efek stimulasi dari polyadenylation pada terjemahan . Faktor inisiasi EIF-4E dan EIF-4G, berkaitan dengan EIF-4A dan 4B EIF-, kemudian membawa mRNA untuk 40S subunit ribosom, dengan EIF-4G berinteraksi dengan EIF-3. 40S subunit ribosom, dalam hubungannya dengan methionyl tRNA terikat dan EIFS, kemudian scan mRNA untuk mengidentifikasi Agustus inisiasi kodon . Ketika Agustus kodon tercapai, EIF-5 memicu hidrolisis GTP terikat untuk EIF-2. Inisiasi faktor (termasuk EIF-2 terikat untuk PDB) yang kemudian dilepaskan, dan subunit 60s mengikat subunit 40S untuk membentuk kompleks inisiasi 80 sel eukariotik .

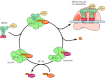
Setelah kompleks inisiasi telah terbentuk, terjemahan hasil oleh pemanjangan polipeptida rantai. Mekanisme perpanjangan di prokariotik dan sel eukariotik sangat mirip ( Gambar 7.11 ). Ribosom memiliki tiga situs untuk tRNA mengikat, yang ditunjuk P (peptidil), A (aminoasil), dan E (keluar) situs. TRNA inisiator methionyl terikat di situs P. Langkah pertama dalam perpanjangan adalah pengikatan tRNA aminoasil sebelah situs A dengan pasangan dengan kedua kodon mRNA. TRNA aminoasil ini diantar ke ribosom oleh faktor elongasi (EF-Tu pada prokariota, Eef-1α pada eukariota), yang dikomplekskan untuk GTP. GTP dihidrolisis terhadap PDB sebagai aminoasil tRNA yang benar dimasukkan ke situs A dari ribosom dan faktor elongasi terikat terhadap PDB dirilis. Persyaratan untuk hidrolisis GTP sebelum EF-Tu atau Eef-1α dilepaskan dari ribosom adalah tingkat-langkah membatasi elongasi dan menyediakan interval waktu selama suatu aminoasil tRNA yang salah, yang akan mengikat kurang kuat untuk mRNA kodon , dapat memisahkan dari ribosom bukannya digunakan untuk sintesis protein. Dengan demikian, pengeluaran energi tinggi GTP pada langkah ini merupakan kontribusi penting untuk sintesis protein yang akurat, yang memungkinkan waktu untuk proofreading dari kodon - antikodon pasangan sebelum ikatan peptida bentuk.
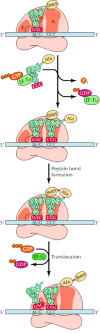
Setelah EF-Tu (atau Eef-1α) telah meninggalkan ribosom, sebuah ikatan peptida dapat dibentuk antara tRNA inisiator methionyl di situs P dan tRNA aminoasil kedua di situs A. Reaksi ini dikatalisis oleh subunit ribosom besar, dengan rRNA memainkan peran penting (seperti yang sudah dibahas). Hasilnya adalah transfer metionin ke aminoasil tRNA di lokasi A ribosom, membentuk peptidil tRNA pada posisi ini dan meninggalkan tRNA inisiator bermuatan di lokasi P. Langkah berikutnya dalam perpanjangan adalah translokasi, yang membutuhkan faktor lain perpanjangan (EF-G pada prokariota, Eef-2 pada eukariota) dan sekali lagi digabungkan dengan hidrolisis GTP. Selama translokasi, ribosom bergerak tiga nukleotida sepanjang mRNA, posisi berikutnya kodon di sebuah situs A kosong. Langkah ini translocates peptidil tRNA dari situs A ke situs P, dan tRNA bermuatan dari situs P ke situs E. Ribosom kemudian dibiarkan dengan tRNA peptidil terikat di lokasi P, dan situs A kosong. Pengikatan tRNA aminoasil baru ke situs A kemudian menginduksi pelepasan tRNA bermuatan dari situs E, meninggalkan ribosom siap untuk penyisipan berikutnya asam amino dalam pertumbuhan polipeptida rantai.
Sebagai perpanjangan terus, EF-Tu (atau Eef-1α) yang dilepaskan dari ribosom terikat PDB harus dikonversi ke bentuk GTP nya ( Gambar 7.12 ). Konversi ini memerlukan faktor perpanjangan ketiga, EF-Ts (Eef-1βγ pada eukariota), yang mengikat ke kompleks EF-Tu/GDP dan mempromosikan pertukaran PDB menuju GTP. Hal ini hasil pertukaran dalam regenerasi EF-Tu/GTP, yang sekarang siap untuk mengawal tRNA aminoasil baru ke situs A ribosom, memulai siklus baru perpanjangan. Peraturan dari EF-Tu dengan mengikat GTP dan hidrolisis menggambarkan sarana umum dari regulasi kegiatan protein. Seperti yang akan dibahas dalam bab-bab selanjutnya, mekanisme yang sama mengontrol kegiatan dari berbagai macam protein yang terlibat dalam regulasi pertumbuhan sel dan diferensiasi, serta dalam transportasi protein dan sekresi.
Pemanjangan polipeptida rantai terus sampai berhenti kodon (UAA, UAG, atau UGA) adalah translokasi ke situs A dari ribosom. Sel tidak mengandung tRNA dengan anticodons pelengkap untuk sinyal-sinyal terminasi, sebaliknya, mereka memiliki faktor rilis yang mengenali sinyal dan menghentikan sintesis protein ( Gambar 7.13 ). Sel prokariotik mengandung faktor-faktor merilis dua yang mengakui pemutusan kodon : RF-1 UAA atau UAG mengakui , dan RF-2 mengakui UAA atau UGA (lihat Tabel 7.1 ). Dalam sel eukariotik faktor merilis single (ERF-1) mengakui semua tiga terminasi kodon . Kedua prokariotik dan sel eukariotik juga mengandung faktor pelepas (RF-3 dan ERF-3, masing-masing) yang tidak mengenal pemutusan spesifik kodon tetapi bertindak bersama-sama dengan RF-1 (atau ERF-1) dan RF-2. Faktor-faktor rilis mengikat ke terminasi kodon di lokasi A dan merangsang hidrolisis dari ikatan antara tRNA dan polipeptida rantai di situs P, mengakibatkan pelepasan menyelesaikan polipeptida dari ribosom. TRNA kemudian dilepaskan, dan subunit ribosom dan template mRNA berdisosiasi.
Messenger RNA dapat diterjemahkan secara bersamaan oleh beberapa ribosom di kedua prokariotik dan sel eukariotik . Setelah satu ribosom telah menjauh dari situs inisiasi, lain dapat mengikat mRNA dan mulai sintesis baru polipeptida rantai. Jadi, mRNA biasanya diterjemahkan oleh serangkaian ribosom , berjarak pada interval 100 sampai 200 nukleotida ( Gambar 7.14 ). Kelompok ribosom terikat ke molekul mRNA disebut, polyribosome atau polysome . Setiap ribosom dalam kelompok fungsi independen untuk mensintesis terpisah polipeptida rantai.
Yang pertama terjemahan langkah dalam bakteri adalah mengikat dari tiga faktor inisiasi (IF-1, IF-2, dan IF-3) dengan subunit ribosom 30S ( Gambar 7.9 ). MRNA dan inisiator N-formylmethionyl tRNA kemudian bergabung kompleks, dengan IF-2 (yang terikat GTP) khusus mengakui tRNA inisiator. JIKA-3 kemudian dilepaskan, memungkinkan 50S subunit ribosom untuk mengasosiasikan dengan kompleks. Asosiasi ini memicu hidrolisis GTP terikat IF-2, yang mengarah ke rilis IF-1 dan IF-2 (terikat untuk PDB). Hasilnya adalah pembentukan kompleks inisiasi 70S (dengan mRNA dan tRNA inisiator terikat ribosom) yang siap untuk memulai ikatan peptida pembentukan selama tahap pemanjangan penerjemahan .


Gambar 7.10
Inisiasi translasi pada sel eukariotik. Faktor inisiasi EIF-3, EIF-1, dan EIF-1A mengikat ribosom subunit 40S. TRNA inisiator methionyl dibawa ke ribosom oleh EIF-2 (dikomplekskan untuk GTP), dan mRNA oleh EIF-4E (yang mengikat ke (more. ..)

Sebagai perpanjangan terus, EF-Tu (atau Eef-1α) yang dilepaskan dari ribosom terikat PDB harus dikonversi ke bentuk GTP nya ( Gambar 7.12 ). Konversi ini memerlukan faktor perpanjangan ketiga, EF-Ts (Eef-1βγ pada eukariota), yang mengikat ke kompleks EF-Tu/GDP dan mempromosikan pertukaran PDB menuju GTP. Hal ini hasil pertukaran dalam regenerasi EF-Tu/GTP, yang sekarang siap untuk mengawal tRNA aminoasil baru ke situs A ribosom, memulai siklus baru perpanjangan. Peraturan dari EF-Tu dengan mengikat GTP dan hidrolisis menggambarkan sarana umum dari regulasi kegiatan protein. Seperti yang akan dibahas dalam bab-bab selanjutnya, mekanisme yang sama mengontrol kegiatan dari berbagai macam protein yang terlibat dalam regulasi pertumbuhan sel dan diferensiasi, serta dalam transportasi protein dan sekresi.
Pemanjangan polipeptida rantai terus sampai berhenti kodon (UAA, UAG, atau UGA) adalah translokasi ke situs A dari ribosom. Sel tidak mengandung tRNA dengan anticodons pelengkap untuk sinyal-sinyal terminasi, sebaliknya, mereka memiliki faktor rilis yang mengenali sinyal dan menghentikan sintesis protein ( Gambar 7.13 ). Sel prokariotik mengandung faktor-faktor merilis dua yang mengakui pemutusan kodon : RF-1 UAA atau UAG mengakui , dan RF-2 mengakui UAA atau UGA (lihat Tabel 7.1 ). Dalam sel eukariotik faktor merilis single (ERF-1) mengakui semua tiga terminasi kodon . Kedua prokariotik dan sel eukariotik juga mengandung faktor pelepas (RF-3 dan ERF-3, masing-masing) yang tidak mengenal pemutusan spesifik kodon tetapi bertindak bersama-sama dengan RF-1 (atau ERF-1) dan RF-2. Faktor-faktor rilis mengikat ke terminasi kodon di lokasi A dan merangsang hidrolisis dari ikatan antara tRNA dan polipeptida rantai di situs P, mengakibatkan pelepasan menyelesaikan polipeptida dari ribosom. TRNA kemudian dilepaskan, dan subunit ribosom dan template mRNA berdisosiasi.
Messenger RNA dapat diterjemahkan secara bersamaan oleh beberapa ribosom di kedua prokariotik dan sel eukariotik . Setelah satu ribosom telah menjauh dari situs inisiasi, lain dapat mengikat mRNA dan mulai sintesis baru polipeptida rantai. Jadi, mRNA biasanya diterjemahkan oleh serangkaian ribosom , berjarak pada interval 100 sampai 200 nukleotida ( Gambar 7.14 ). Kelompok ribosom terikat ke molekul mRNA disebut, polyribosome atau polysome . Setiap ribosom dalam kelompok fungsi independen untuk mensintesis terpisah polipeptida rantai.
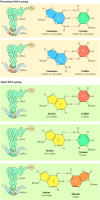
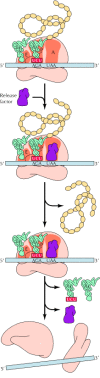
Meskipun transkripsi adalah tingkat dasar di mana gen ekspresi dikontrol, terjemahan mRNA juga diatur di kedua prokariotik dan sel eukariotik . Salah satu mekanisme regulasi translasi pengikatan represor protein , yang menghambat penerjemahan , untuk urutan mRNA spesifik. Contoh terbaik dari ini memahami mekanisme dalam sel eukariotik adalah regulasi sintesis feritin, protein yang menyimpan zat besi dalam sel. Para terjemahan mRNA feritin diatur oleh pasokan besi: feritin Lebih disintesis jika besi berlimpah ( Gambar 7.15 ). Peraturan ini dimediasi oleh protein yang (tanpa adanya besi) mengikat urutan (respon unsur besi, atau IRE) di wilayah diterjemahkan 5 'mRNA feritin, yang menghalangi penerjemahan . Dalam kehadiran besi, represor tidak lagi mengikat IRE dan feritin terjemahan mampu melanjutkan.
Sangat menarik untuk dicatat bahwa pengaturan terjemahan mRNA feritin oleh besi mirip dengan regulasi stabilitas mRNA reseptor transferin, yang telah dibahas pada bab sebelumnya (lihat Gambar 6.48 ). Yakni, stabilitas mRNA reseptor transferin diatur oleh protein mengikat pada IRE di wilayah diterjemahkan 3 nya '. Protein yang sama mengikat ke IREs dari kedua feritin dan mRNA reseptor transferin. Namun, konsekuensi dari protein yang mengikat dua IREs sangat berbeda. Protein terikat pada reseptor transferin IRE melindungi mRNA dari degradasi daripada yang menghambat penerjemahan . Efek ini mungkin berbeda hasil dari lokasi yang berbeda dari IRE dalam dua mRNA. Untuk berfungsi sebagai represor situs-mengikat, IRE harus terletak di dalam 70 nukleotida dari tutup 5 'mRNA feritin, menunjukkan bahwa protein yang mengikat ke IRE blok terjemahan dengan mengganggu dengan pengakuan topi dan mengikat ribosom subunit 40S. Daripada menghambat terjemahan , protein yang mengikat dengan urutan yang sama di daerah tidak ditranslasi 3 'mRNA reseptor transferin melindungi mRNA dari degradasi nuklease. Pengikatan protein peraturan yang sama untuk situs yang berbeda pada molekul mRNA sehingga dapat memiliki efek yang berbeda pada gen ekspresi, dalam satu kasus menghambat terjemahan dan di lain menstabilkan mRNA untuk meningkatkan sintesis protein.
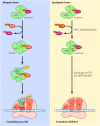
Mekanisme lain regulasi translasi pada sel eukariotik , menghasilkan efek global pada aktivitas translasi keseluruhan bukan pada terjemahan mRNA spesifik, melibatkan modulasi dari aktivitas faktor inisiasi, terutama EIF-2. Seperti telah dibahas, EIF-2 (dikomplekskan dengan GTP) berikatan dengan tRNA inisiator methionyl, membawanya ke ribosom. Rilis selanjutnya EIF-2 disertai dengan hidrolisis GTP, meninggalkan EIF-2 sebagai sebuah kompleks PDB tidak aktif. Untuk berpartisipasi dalam siklus lain inisiasi, kompleks eIF-2/GTP harus diregenerasi oleh pertukaran PDB menuju GTP. Pertukaran ini dimediasi oleh faktor lain, EIF-2B. Kontrol EIF-2 kegiatan dengan mengikat GTP dan hidrolisis dengan demikian mirip dengan EF-Tu (lihat Gambar 7.12 ). Namun, regulasi EIF-2 menyediakan titik kontrol kritis dalam berbagai sel eukariotik . Secara khusus, EIF-2 dapat terfosforilasi oleh regulasi protein kinase . Ini fosforilasi blok pertukaran PDB menuju GTP, sehingga menghambat inisiasi penerjemahan . Salah satu jenis sel di mana seperti fosforilasi terjadi adalah retikulosit, yang dikhususkan untuk sintesis hemoglobin ( Gambar 7.16 ). Para terjemahan mRNA globin dikendalikan oleh ketersediaan heme: mRNA ini diterjemahkan hanya jika heme yang memadai tersedia untuk membentuk molekul hemoglobin fungsional. Dengan tidak adanya heme, suatu protein kinase yang phosphorylates EIF-2 diaktifkan, dan selanjutnya penerjemahan dihambat. Mekanisme serupa telah ditemukan untuk mengontrol sintesis protein dalam jenis sel lain, terutama sel yang terinfeksi virus di mana sintesis protein virus dihambat oleh interferon.
Studi-studi lain telah terlibat EIF-4E, yang mengikat tutup 5 'mRNA, sebagai translasi protein regulator. Misalnya, hormon insulin merangsang sintesis protein dalam sel lemak dan sel-sel otot. Ini efek dari insulin adalah dimediasi, setidaknya sebagian, oleh fosforilasi dari protein yang terkait dengan EIF-4E, mengakibatkan stimulasi EIF-4E aktivitas dan peningkatan tingkat inisiasi translasi.
Translational regulasi sangat penting selama perkembangan awal. Seperti dibahas dalam Bab 6, berbagai mRNA disimpan pada oosit dalam bentuk tidak diterjemahkan, sedangkan terjemahan dari mRNA yang disimpan diaktifkan pada saat pembuahan atau tahap akhir pembangunan. Salah satu mekanisme regulasi translasi tersebut adalah dikontrol polyadenylation mRNA oosit. MRNA diterjemahkan Banyak disimpan pada oosit dengan singkat ekor poli-A (kira-kira 20 nukleotida ). Ini mRNA disimpan selanjutnya direkrut untuk terjemahan pada tahap yang sesuai dikembangkan oleh mereka pemanjangan ekor poli-A untuk beberapa ratus nukleotida . Selain itu, terjemahan dari beberapa mRNA selama pengembangan tampaknya diatur oleh represor protein yang mengikat urutan tertentu di daerah tidak ditranslasi 3 mereka. Ini peraturan protein juga dapat langsung mRNA untuk daerah tertentu dari telur atau embrio, yang memungkinkan sintesis lokal dari dikodekan protein selama perkembangan embrio.
Sangat menarik untuk dicatat bahwa pengaturan terjemahan mRNA feritin oleh besi mirip dengan regulasi stabilitas mRNA reseptor transferin, yang telah dibahas pada bab sebelumnya (lihat Gambar 6.48 ). Yakni, stabilitas mRNA reseptor transferin diatur oleh protein mengikat pada IRE di wilayah diterjemahkan 3 nya '. Protein yang sama mengikat ke IREs dari kedua feritin dan mRNA reseptor transferin. Namun, konsekuensi dari protein yang mengikat dua IREs sangat berbeda. Protein terikat pada reseptor transferin IRE melindungi mRNA dari degradasi daripada yang menghambat penerjemahan . Efek ini mungkin berbeda hasil dari lokasi yang berbeda dari IRE dalam dua mRNA. Untuk berfungsi sebagai represor situs-mengikat, IRE harus terletak di dalam 70 nukleotida dari tutup 5 'mRNA feritin, menunjukkan bahwa protein yang mengikat ke IRE blok terjemahan dengan mengganggu dengan pengakuan topi dan mengikat ribosom subunit 40S. Daripada menghambat terjemahan , protein yang mengikat dengan urutan yang sama di daerah tidak ditranslasi 3 'mRNA reseptor transferin melindungi mRNA dari degradasi nuklease. Pengikatan protein peraturan yang sama untuk situs yang berbeda pada molekul mRNA sehingga dapat memiliki efek yang berbeda pada gen ekspresi, dalam satu kasus menghambat terjemahan dan di lain menstabilkan mRNA untuk meningkatkan sintesis protein.
Mekanisme lain regulasi translasi pada sel eukariotik , menghasilkan efek global pada aktivitas translasi keseluruhan bukan pada terjemahan mRNA spesifik, melibatkan modulasi dari aktivitas faktor inisiasi, terutama EIF-2. Seperti telah dibahas, EIF-2 (dikomplekskan dengan GTP) berikatan dengan tRNA inisiator methionyl, membawanya ke ribosom. Rilis selanjutnya EIF-2 disertai dengan hidrolisis GTP, meninggalkan EIF-2 sebagai sebuah kompleks PDB tidak aktif. Untuk berpartisipasi dalam siklus lain inisiasi, kompleks eIF-2/GTP harus diregenerasi oleh pertukaran PDB menuju GTP. Pertukaran ini dimediasi oleh faktor lain, EIF-2B. Kontrol EIF-2 kegiatan dengan mengikat GTP dan hidrolisis dengan demikian mirip dengan EF-Tu (lihat Gambar 7.12 ). Namun, regulasi EIF-2 menyediakan titik kontrol kritis dalam berbagai sel eukariotik . Secara khusus, EIF-2 dapat terfosforilasi oleh regulasi protein kinase . Ini fosforilasi blok pertukaran PDB menuju GTP, sehingga menghambat inisiasi penerjemahan . Salah satu jenis sel di mana seperti fosforilasi terjadi adalah retikulosit, yang dikhususkan untuk sintesis hemoglobin ( Gambar 7.16 ). Para terjemahan mRNA globin dikendalikan oleh ketersediaan heme: mRNA ini diterjemahkan hanya jika heme yang memadai tersedia untuk membentuk molekul hemoglobin fungsional. Dengan tidak adanya heme, suatu protein kinase yang phosphorylates EIF-2 diaktifkan, dan selanjutnya penerjemahan dihambat. Mekanisme serupa telah ditemukan untuk mengontrol sintesis protein dalam jenis sel lain, terutama sel yang terinfeksi virus di mana sintesis protein virus dihambat oleh interferon.
Studi-studi lain telah terlibat EIF-4E, yang mengikat tutup 5 'mRNA, sebagai translasi protein regulator. Misalnya, hormon insulin merangsang sintesis protein dalam sel lemak dan sel-sel otot. Ini efek dari insulin adalah dimediasi, setidaknya sebagian, oleh fosforilasi dari protein yang terkait dengan EIF-4E, mengakibatkan stimulasi EIF-4E aktivitas dan peningkatan tingkat inisiasi translasi.
Translational regulasi sangat penting selama perkembangan awal. Seperti dibahas dalam Bab 6, berbagai mRNA disimpan pada oosit dalam bentuk tidak diterjemahkan, sedangkan terjemahan dari mRNA yang disimpan diaktifkan pada saat pembuahan atau tahap akhir pembangunan. Salah satu mekanisme regulasi translasi tersebut adalah dikontrol polyadenylation mRNA oosit. MRNA diterjemahkan Banyak disimpan pada oosit dengan singkat ekor poli-A (kira-kira 20 nukleotida ). Ini mRNA disimpan selanjutnya direkrut untuk terjemahan pada tahap yang sesuai dikembangkan oleh mereka pemanjangan ekor poli-A untuk beberapa ratus nukleotida . Selain itu, terjemahan dari beberapa mRNA selama pengembangan tampaknya diatur oleh represor protein yang mengikat urutan tertentu di daerah tidak ditranslasi 3 mereka. Ini peraturan protein juga dapat langsung mRNA untuk daerah tertentu dari telur atau embrio, yang memungkinkan sintesis lokal dari dikodekan protein selama perkembangan embrio.





Tidak ada komentar:
Posting Komentar